Características químicas
Las propiedades químicas del indol son, en general, bastante similares a aquellos del pirrol teniendo en cuenta la marcada influencia estabilizante.
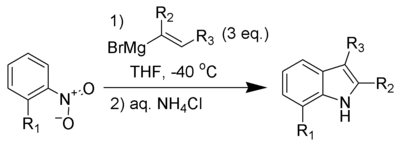
El indol sufre sustitución electrofílica aromática en la posición 3.
El indol por si mismo ocurre libre en los jasmines, en las flores de la naranja, frutos cítricos, etc. Se forma por la descomposición de residuos del aminoácido triptófano en proteínas. Muchos derivados del triptófano son de gran interés biológico.
El L-triptófano un α-aminoácido esencial al hombre y muchos organismos vivientes, es constituyente de muchas proteínas. Se descompone si las proteínas se hidrolizan por ácidos pero no cuando se emplean álcalis.
El triptófano que contiene el sistema de anillos del indol sufre muchas transformaciones en animales. Por ejemplo, es decarboxilado a triptamina e hidroxilado en la posición 5, para formar 5-hidroxitriptamina (o serotonina) de inmenso interés fisiológico y bioquímico

L-Triptófano Triptamina Serotonina
Su estructura puede representarse como XIV o XV:
La estructura XIV es una de las 6 posibles contribuyentes al híbrido de resonancia, considerada como la mas importante.
Como se observa el sistema de los dos anillos es completamente
La energía de resonancia del indol, calculada de su calor de combustión es ~47-49 kcal/mol.
El aumento en energía de resonancia (24 kcal/mol) sobre el
pirrol (23-27 kcal/mol) muestra el efecto de fusionar otro anillo aromático.